Besoin d'information ?
Contactez-nous
You are here
BioFire® Respiratory Panel 2.1 plus (RP2.1 plus)
Diagnostic syndromique des infections respiratoires aigües
Lorsque la saison des virus respiratoires arrive, entraînant un afflux de personnes aux Urgences, le nouveau coronavirus responsable du COVID-19 sera le principal suspect. Pourtant plusieurs pathogènes provoquent des infections respiratoires présentant des symptômes similaires. Avec le BioFire® Respiratory Panel 2.1 plus (RP2.1plus) vous pouvez désormais tester 23 pathogènes respiratoires courants, y compris SARS-CoV-2, tous avec un seul test et en 45 minutes.
- Rapide
Résultats en 45 minutes. - Fiable
Sensibilité à 97,4%. Spécificité à 99,4%1 - Détection simultanée
Détection de 23 pathogènes respiratoires
(19 virus et 4 bactéries) dans le prélèvement de l’écouvillon nasopharyngé
Besoin d'information complémentaire ?
Application Clinique
Juillet 2020
1 TEST. 23 CIBLES. RESULTATS EN 45 MINUTES.
En 45 minutes seulement, le test BioFire® RP2.1plus fournit des résultats fiables pour l’identification de 23 cibles (virus et bactéries) responsables des infections respiratoires aigües, SARS-CoV-2 compris.
BioFire® RP2.1plus permet ainsi :
- Une meilleure documentation microbiologique (plus d’étiologies, détection des coïnfections)
- Un triage rapide des patients
- Une mise en place appropriée des mesures d’isolement
- Grâce à un résultat très rapide, l’amélioration de la prise en charge des patients, en termes de diminution de durée moyenne de séjour à l’hôpital, de l’antibiothérapie et des examens complémentaires
Ce panel est marqué CE-IVD pour l’analyse de l’écouvillon nasopharyngé sur les systèmes BioFire® FilmArray® Torch et FilmArray® V2.0.
Télécharger le certificat CE-IVD BioFire RP2.1plus
Menu du BIOFIRE® RP2.1plus panel
Détection et identification de 23 cibles responsables des infections respiratoires aigües,
SARS-CoV-2 compris :
| Virus | Bactéries |
|
|
Meilleur rendement diagnostique grâce à l’approche syndromique
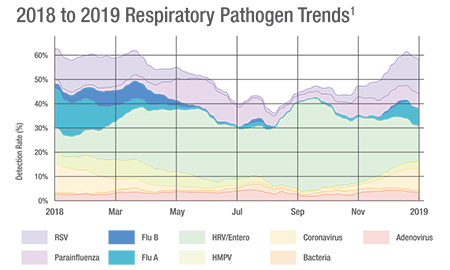
Les données de BioFire® Syndromic Trends2 montrent que même pendant le pic épidémique de grippe saisonnière, la grippe représente moins d’un tiers des pathogènes respiratoires détectés pendant cette période. Une détection simultanée de plusieurs pathogènes signifie moins de diagnostics biologiques manqués.
Un délai de rendu des résultats drastiquement diminué
Selon l’expérience du CHU Limoges, le délai moyen de rendu des résultats, entre l’heure de prélèvement et la confirmation du résultat, a diminué de 23h20 (avant l’implantation du BioFire®)
à 2h17 avec BioFire® RP2plus pendant l’épidémie de grippe saisonnière pour les patients des Urgences.3
Ces délais sont comparables à ceux observés dans la littérature pour cette technique (ex. étude ResPOC4 : 2,3h dans le bras BioFire® versus 37.1h dans le bras contrôle, p<0.0001).
Diminue la durée de séjour à l’hôpital
L’étude ResPOC réalisée au Royaume Uni, ouverte, randomisée et contrôlée démontre la réduction de la durée de séjour à l’hôpital d’une journée en moyenne (5.7 jours dans le groupe FilmArray® versus 6.8 jours dans le groupe routine avec des tests PCR du laboratoire, p=0,04).4
Réduit des examens complémentaires
L’utilisation du panel Respiratoire BioFire® réduit la réalisation de radiographies pulmonaires chez les enfants de 19%.5
Diminue la durée d’antibiothérapie
Les patients testés avec BioFire® RP ont eu la durée d’antibiothérapie intra-veineuse plus courte grâce à la désescalade plus rapide, en comparaison avec des patients dans le groupe de tests PCR de routine.6
Bénéfices patients – Témoignages
« L’amélioration substantielle du délai de rendu des résultats (2h17 au lieu de 23h20) a permis une hospitalisation éclairée des patients en chambre à lits multiples et un fléchage plus rapide vers le service adapté. »
Pr ROGEZ – CHU Limoges, P.O. RICAI 2019
« Le PCR multiplexe améliore le diagnostic étiologique, apporte un gain important en sensibilité, réduit le délai diagnostique et accroit la disponibilité des résultats aux cliniciens avec les techniques rapides. Le risque infectieux viral est mieux maitrisé, la décision d’isolement mieux ciblée, le traitement antigrippal est aussi mieux ciblé et donné plus rapidement. L’exposition aux antibiotiques est diminuée car, même si l’antibiothérapie est initiée pour une même proportion des patients, elle est plus vite arrêtée et mieux réévaluée. Le parcours de soins est amélioré car la décision d’hospitalisation est mieux documentée et les durées de séjour sont plus fiables. »
Dr. VISSEAUX – Hôpital Bichat Paris, P.O. JFBM 2017 (Spectra Biologie n°233, 2018)
« La valeur ajoutée de l’identification d’étiologie virale dans les Infections Respiratoires Basses aux Urgences repose sur une précision diagnostique, une orientation du patient et un isolement respiratoire.»
Pr. HAUSFATER, Hôpital Pitié-Salpêtrière Paris, P.O. RICAI 2018
1) Performances issues des études cliniques. Pour plus d'information, lire la notice technique du produit
2) BioFire Syndromic Trends : www.syndromictrends.com
3) Pr. Rogez, Biologiste Infos n°103. Déc 2019 – Janvier 2020
4) Brendish NJ et al., Lancet Respir Med 2017
5) Subramony A et al., J Pediatr. 2016
6) Shengchen D. et al., Clin Microbiol Infect 2019
Fabricant : BioFire Diagnostics, LLC - 390 Wakara Way, Salt Lake City - UT 84108, USA.
BioFire est une filiale détenue à 100% par bioMérieux.
Ces produits sont destinés aux professionnels de santé (Pour usage diagnostique in-vitro FDA Cleared | Certifié CE-IVD)
Application Clinique
Juillet 2020
BioFire® Respiratory Panel 2.1 plus (RP2.1plus)
| Référence Produit | Nombre de tests / coffret |
|---|---|
| 423740 | 30 tests |
BioFire® RP2.1plus Panel est un test moléculaire qui intègre la purification des acides nucléiques,
la PCR nichée multiplexe et la détection en un seul consommable – cassette FilmArray®,
destiné à être utilisé avec les systèmes BioFire® FilmArray® V2.0 et Torch.
| Manipulation de l’échantillon | Résultats rapides |
|---|---|
| Type d’échantillon : Ecouvillonage nasopharyngé (ENP) dans 3mL max. de milieu de transport |
Temps de manipulation : approximativement 2 minutes |
| Volume de l’échantillon : 300 μL | Temps de l’analyse : 45 minutes |
Performances globales du BioFire RP2.1plus
Sensibilité globale à 97,4%. Spécificité globale à 99,4%1
Zoom sur performances cliniques SARS-CoV-2 : Sensibilité à 98%. Spécificité à 100%1
Le Centre National de Référence (CNR) des virus des Infections Respiratoires (laboratoire du Pr. Bruno LINA) a évalué la sensibilité analytique du BioFire RP2.1plus pour la détection du SARS-CoV-2 par comparaison de la technique de référence du CNR – PCR Pasteur.
Le BioFire RP2.1plus présente une sensibilité similaire à la technique de référence du CNR.
Fabricant : BioFire Diagnostics, LLC - 390 Wakara Way, Salt Lake City - UT 84108, USA.
BioFire est une filiale détenue à 100% par bioMérieux.
Ces produits sont destinés aux professionnels de santé (Pour usage diagnostique in-vitro FDA Cleared | Certifié CE-IVD)
Lire les instructions figurant sur l’étiquetage et/ou la notice d’utilisation du/des produit(s)
- Diagnostic Clinique
- Microbiologie Industrielle
- Services
- Actus & Évènements
- Documents
- À propos
- Ma sélection
bioMérieux France - 5, rue des Aqueducs - B.P 10 - 69290 Craponne - France
- Mentions légales
- Vie privée
- Cookies
- Plan du site
- Contact
- Copyright 2022 bioMérieux SA