
Besoin d'information ?
Contactez-nous
You are here
VIDAS® EBV - Panel
Diagnostic de la mononucléose infectieuse
Le panel VIDAS® Epstein-Barr Virus (EBV) fournit une combinaison de trois tests destinés à confirmer rapidement un diagnostic de mononucléose infectieuse et à établir clairement le stade de l’infection.
- 4 marqueurs spécifiques à EBV en 3 tests
- Diagnostic automatisé pouvant être effectué au sein même de votre laboratoire afin de communiquer le jour même les résultats aux cliniciens
- Résultat de la sérologie EBV en 40 minutes
- Protocole identique pour les 3 tests
Besoin d'information complémentaire ?
Application Clinique
Juin 2015
Grâce à la détection du principal agent responsable de la mononucléose infectieuse (MNI), le panel VIDAS® EBV permet de confirmer un diagnostic clinique de la maladie et d’éliminer les autres pathologies susceptibles d’entraîner des symptômes de type MNI. Un diagnostic rapide et clair permet de rassurer les patients et les médecins et d’éviter les investigations et les traitements inutiles.
Le panel comprend trois tests automatisés pour la détection qualitative des anticorps anti-VCA IgM, anti-EBNA IgG et anti-VCA IgG/anti-EA IgG dans le sérum humain à l’aide de la technique ELFA. Basés sur les peptides propriétaires, ces essais sont conçus pour fournir les réponses anticorps les plus pertinentes afin de définir le statut des patients en toute certitude.
Le tableau sérologique
Critères rationnels pour définir le statut des patients EBV chez les immunocompétents
cinetique_fr-1.jpg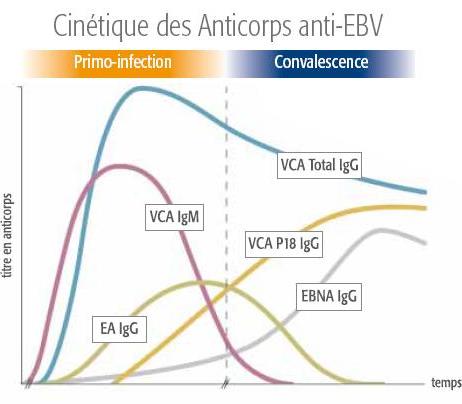 Show in media library: VCA = Viral Capsid Antigen (Antigène de la capside virale) |
Les tests spécifiques à VIDAS® EBV sont liés à la réponse des anticorps en fonction du temps à différents antigènes produits tout au long du cycle de vie du virus Epstein-Barr.
3 paramètres sérologiques (VCA IgM, VCA IgG et EBNA IgG) sont requis dans le cadre du diagnostic spécifique au stade EBV2,3 :
- Primo-infection
- Infection ancienne
- Absence d’infection
Sérologie EBV pour un diagnostic fiable
- Plus fiable que les tests anticorps Monospot ou hétérophiles1,2*
- Permet de confirmer ou d’exclure définitivement la thèse de la mononucléose infectieuse dans la plupart des cas**
* Pour plus d’informations, reportez-vous à l’onglet Ressources.
** Le diagnostic est établi en tenant compte de l’âge du patient et du tableau clinique complet.
Détection combinée des EA IgG et des VCA IgG pour une confirmation plus rapide
Etant donné que les EA IgG n’apparaissent que chez 80 % des patients durant la phase aiguë de la mononucléose infectieuse, le fait de combiner les deux marqueurs en un seul test permet de confirmer la maladie grâce à une détection très précoce des IgG.
Interprétation
| VIDAS EBV VCA IgM |
VIDAS EBV VCA/EA IgG |
VIDAS EBV EBNA IgG |
Interprétation VIDAS EBV (résultats combinés) |
|---|---|---|---|
| - | - | - | Séronégatif |
| + | - | - | MNI / primo infection récente |
| + | + | - | MNI / Primo infection aiguë |
| - | + | +(1) | Séropositif (infection ancienne) |
| - | - | + | EBNA igG isolées(2) |
| - | + | - | VCA/EA IgG isolées(2) |
| + | + | + | Profil indéterminé(2) |
+ : Présence d’anticorps
(2) à contrôler sur prélèvement ultérieur réalisé 1 à 2 semaines plus tard.
Avantages
Flexible et facile à utiliser
- Protocole identique pour les 3 tests
- Disponibilité 24 h/24 et 7 j/7
- Calibrateurs et contrôles inclus dans le coffret
- Conditionnement de 30 tests
- Calibration tous les 28 jours
- Résultats en 40 minutes pour les 3 tests VIDAS® EBV
Les tests VIDAS® EBV sont réalisés sur les automates d’immunoanalyse VIDAS®, reconnus dans le monde entier pour leur simplicité, leur flexibilité et leur précision.
Publications
- Macsween KF and Crawford DH. Epstein-Barr virus – recent advances. Lancet Infectious Diseases. 2003;3:131-140.
- Hess RD, et al. Routine Epstein-Barr Virus Diagnostics from the Laboratory Perspective: Still challenging after 35 years. J Clin Microbiology 2004;42:3381-3387.
- Lupo J, et al. Performance of Two Commercially Available Automated Immunoassays for the Determination of Epstein-Barr Virus Serological Status. Clin. Vaccine Immunol. 2012, 19(6):929. DOI: 10.1128/CVI.00100-12.
Fabricant : bioMérieux SA.
Ces produits sont destinés aux professionnels de santé
Application Clinique
Juin 2015
| VIDAS® VCA IgM | VIDAS® VCA/EA IgG | VIDAS® EBNA IgG | |
|---|---|---|---|
| Référence | 30 237 | 30 236 | 30 235 |
| Tests / coffret | 30 | 30 | 30 |
| Temps de résultat | 40 minutes | 40 minutes | 40 minutes |
| Type échantillon | Sérum | Sérum | Sérum |
| Volume échantillon | 100 µL | 100 µL | 100 µL |
| Calibration | Tous les 28 jours | Tous les 28 jours | Tous les 28 jours |
Fabricant : bioMérieux SA.
Ces produits sont destinés aux professionnels de santé
Bibliographies
- Lupo J, et al. Performance of Two Commercially Available Automated Immunoassays for the Determination of Epstein-Barr Virus Serological Status. Clin. Vaccine Immunol. 2012, 19(6):929. DOI: 10.1128/CVI.00100-12.
- Koidl C., et al. Performance of new enzyme-linked fluorescent assays for detection of Epstein-Barr virus specific antibodies in routine diagnostics. Wien KlinWorchenschr. 2011 DOI 10.1007/s00508-011-1561-z
- Determination of EBV serostatus prior to kidney transplantation: Comparison of VIDAS(®), LIAISON(®) and immunofluorescence assays. Johannessen I, Noel M, Galloway A, Black S, Shearman M, Graham C. J Virol Methods. 2014 Jul;203:107-11.
- Johannessen I, et al. Determination of EBV serostatus prior to kidney transplantation: Comparison of VIDAS®, LIAISON® and immunofluorescence assays. J. Virol. Methods (2014)
Documentation disponible
"La mononucléose infectieuse - 10 questions et réponses"
Fabricant : bioMérieux SA.
Ces produits sont destinés aux professionnels de santé
Lire les instructions figurant sur l’étiquetage et/ou la notice d’utilisation du/des produit(s)
- Diagnostic Clinique
- Microbiologie Industrielle
- Services
- Actus & Évènements
- Documents
- À propos
- Ma sélection
bioMérieux France - 5, rue des Aqueducs - B.P 10 - 69290 Craponne - France
- Mentions légales
- Vie privée
- Cookies
- Plan du site
- Contact
- Copyright 2022 bioMérieux SA





